|
|
 发表于 2021-9-25 13:49:00
|
发表于 2021-9-25 13:49:00
|
查看: 99 |
回复: 0
延缓老年性痴呆早期症状的新方法
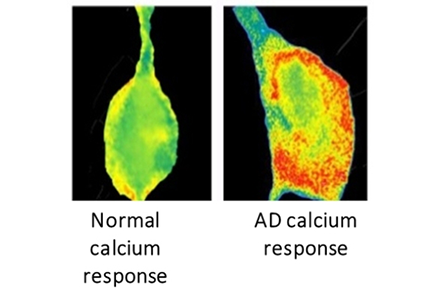
AD脑细胞中钙离子的过量释放(右图红色区域)与健康脑细胞中钙离子的正常量释放相互对比(左图)。图片来源:CLARK BIGGS
赶在记忆力衰退或其他病状出现之前就“早发现早治疗”是目前研究人员抵御阿尔茨海默病的新准则。其根本原因在于,当痴呆症状出现时,阿尔茨海默病很可能已经在摧毁患者
目前,大规模的临床试验正在对一些用于清理大脑中细胞碎屑的药物进行测试(细胞碎屑指的是淀粉样蛋白与Tau蛋白之间形成的聚合体,该聚合体有可能最终破坏大脑细胞)。但到目前为止,对此种治疗手段的评价褒贬不一,并不尽如人意。
于是,一些研究人员选择了一个不同的研究方向。他们已经开始探究在淀粉样蛋白同Tau蛋白形成斑块和缠结之前大脑中发生了些什么,同时关注该疾病初发阶段中可能有效的医疗干预。
阿尔茨海默症药物研发基金(The Alzheimer’s Drug Discovery Foundation)近年来大力资助新型药剂,此类药剂不再以淀粉体为目标而是针对该病的其他临床表现,例如炎症和神经元能量代谢。
上周在泽西城召开的一次基金会议中,罗莎琳德富兰克林医科大学(Rosalind Franklin University of Medicine and Science)芝加哥医学院的神经学家Grace Stutzmann介绍了她的研究工作:修复一个在阿尔茨海默病中出现异常的、名为“钙离子信号传导(calcium signaling)”的基础细胞过程。
以下是编辑过的谈话记录
科学美国人:你能否向我们读者朋友简单解释一下什么是大脑中的钙离子信号及其在阿尔茨海默病中会发生什么异常?
尽管很多人都知道钙是骨骼的组成部分,其实钙也是细胞功能的一个重要特征。大脑细胞中的钙离子有着诸多重要的作用:能量代谢中激活基因转录蛋白、细胞内部传递信号甚至能够调控细胞凋亡。其中,与阿尔茨海默病联系最为紧密的是其在突触(神经元间的结合点)间进行神经传输与通信时起到的核心作用。 我们的记忆正是依赖于上述细胞机制而得以形成并保存的。在阿尔茨海默病中,神经元会释放过量的钙离子,这会触发或加速阿尔茨海默病(AD)中诸多常见的病理过程,尤其是能够导致记忆衰退的病变。

Grace Stutzmann教授. 照片来源: ROSALIND FRANKLIN UNIVERSITY OF MEDICINE AND SCIENCE
停止异常的钙离子信号传导是一个好的介入点吗?这是因为钙离子出现异常时所处的特殊病程阶段吗?
我们认为钙离子信号紊乱发生于疾病的早期阶段,因而是“诱因”的一部分而不仅仅是一个后期的“结果”。该观点从机制上支持了以钙离子异常作为目标的治疗策略。重要的是,我们实验室已经找到了钙离子过量释放的特殊通道(鱼尼丁受体),该发现为防止钙离子信号紊乱提供了一个有效的靶区。
能具体解释下你们的工作内容吗?
通过在一些AD的实验模型中检验其作用,我们首先确认了该特定钙离子通道在AD中的重要性,从AD患者身上我们也确认了人类大脑中的异常。然后我们又重新回到模型(包括基因工程处理后患有AD病的小鼠)中,测试已知药物对钙离子通道的抑制能力,并得到了极为鼓舞人心的结果。这些药物不仅能逆转钙离子过量,而且可以改善AD的很多其他病变,比如淀粉体和Tau蛋白的堆积、神经元的减少和突触可塑性的受损。上述发现促成了我们着手设计研发自己的化合物,该化合物将更加精准地瞄准受体同时更高效地进入大脑。我们很快与一个药物化学研究组进行合作,一同设计并合成了一些列的新化合物,并在上面提到的AD模型系统中进行测试。
如何检测无临床症状的人是否有患病风险?
啊,问题就在这里。很多研究组,包括我们自己,都在寻找估算AD患病风险或可能性大小的生物标志。很多人在使用斑块(最近是tau蛋白病异常)的脑成像作为AD风险的指示器。但是由于斑块和认知功能之间并没有太大的关联,我们大多怀疑其作为诊断或生物标志工具的可行性。因此,目前还很难准确地评估大多数人的患病风险。实际上,我们希望的是能捕捉到早期的症状(比如行为和记忆的紊乱),然后阻止进一步的认知损坏。
请和我们谈一谈你创办的公司和正在研发的药物。
当我们意识到我们已经拥有了一个新颖高效的AD治疗策略、一个新化合物的资料库以及测试我们的化合物所需的强大生物筛选试验能力时,我们开始试图确定哪些化合物能在治疗AD中切实有效。令人振奋的是第一代化合物就已经有所斩获:在AD模型中细胞内钙离子信号传导得以恢复为正常水平,一些与AD相关的病理特征也发生减少。
之后不久,我们与SmartHealth进行合作(SmartHealth是位于北芝加哥的一家生物科技创业孵化器)共同创立了NeuroLucent公司来加速新化合物的研发、测试和优化过程,希望能尽快将其投入临床治疗。SmartHealth的顾问Glenn Gottfried在NeuroLucent中担任主席一职。我还邀请了我在Rosalind Franklin大学的两位同事——药物化学家John Buolamwini博士和分子生物学家Robert Marr博士——加入了我们的团队。我们仍然只是一家年轻的创业公司,但是通过筹集资金和建立合作,我们将扩大产量,同时推动化合物从实验室诞生到通过美国食品药物管理局(FDA)审批这一复杂的过程。
难道以前没有人尝试过修正钙离子信号吗?你们的工作是如何与众不同的?
没错,我们并不是最早尝试使用钙离子通道策略来治疗AD的。然而,之前的方法所针对的目标是类型完全不同的钙离子通道,这些通道位于细胞外膜,似乎与AD病理间并无明确关系。比如说,在细胞表面有一类钙离子通道,兴奋性活动能够将其激活并打开细胞通道。抑制此类钙离子通道的药物在某些条件下是卓有成效的,例如高血压,但其并不能提高认知能力或者减缓AD症状。我们也一直利用AD实验模型研究这些通道,它们总是运转正常。既然在AD中此类钙离子通道似乎既无异常表现又不是诱因,我能理解为什么从前的临床努力都以失败告终了。
我们方法的与众不同之处在于:我们瞄准的钙离子通道位于细胞内,其控制着来自内质网(ER)的钙离子信号传递(ER是一个有高浓度钙离子的细胞组分)。在AD发生时,ER膜上的通道将从其内部储存中释放过量的钙离子,由此触发大量的病理现象。我们正在尝试使穿过ER通道的钙离子信号恢复正常,并且以此特定来源作为目标。这在机制上与以前的尝试是截然不同的。此外,我们还已知该钙离子源在实验AD模型和人类AD患者中都会发生功能异常。几个研究实验室已经在很多不同的模型中证实了这一现象。假如仅仅只是我们实验室有这样的发现的话,我是不会轻易地相信的。
既然其它阿尔茨海默病药物的疗效都不理想,你的方案是不是尤为值得考虑?
我确实非常关心这个问题,不一定必须是“我的方案”,而是任何在机制上站得住脚的方案(不同于最近那一系列失败的临床试验)。这些令人失望的化合物大多都以减少一种蛋白质(β-淀粉样蛋白斑块)的聚合为目标。此外,尽管出现斑块是AD诊断的重要依据,但我们尚不清楚其在疾病过程中的作用以及β-淀粉样蛋白的集聚究竟与记忆衰退之间有怎样的联系。事实上,有一些药物可以很有效地减少大脑中的β-淀粉样蛋白,但却没有任何改善认知能力的功效。
同时,我们知道记忆功能与人脑中淀粉蛋白的含量之间并无明显关联。实际上,在那些超过九十五岁的“老寿星们”的大脑中也有可能存在着和AD患者们一样多的淀粉斑块,但这并不影响他们在二十分钟内完成字谜游戏、当桥牌俱乐部主席或者打得一手漂亮的高尔夫球。纵观全局,我认为我们应该回到原点正本清源,努力弄清楚AD的早期机制(因为其与记忆衰退是直接相关的)。我们可以基于此研究得到的数据来制定治疗策略。我们认为研究早期和中枢信号路径是非常有前景的,其能够影响包括淀粉蛋白产生、tau蛋白病理、神经元炎症和记忆衰退等AD症状,也许除了钙离子紊乱外还存在着其他有效的目标。我认为,学术界应该加大力度寻找那个导致AD多方面疾病过程的共同原因。我们实验室仍在继续寻找AD的病因,目前正在使用人类神经元来验证我们的方法。但作为一个研究领域,研究工作者们应秉承“欲先制敌,必先知敌”的原则,更好地了解我们所抵御的疾病以此寻求最优的取胜之道。
翻译:郭昂 审校:刘财兴
原文链接:
https://blogs.scientificamerican.com/talking-back/a-new-tack-to-stave-off-alzheimer-s-years-before-the-first-symptom/ |
|